SBH Comenta
“Noninvasive tests accurately identify advanced fibrosis due to NASH: baseline data from STELLAR Trials”

Noninvasive tests accurately identify advanced fibrosis due to NASH: baseline data from STELLAR Trials
Amanda Cheung, MD; Brent A. Neuschwander-Tetri, MD; David E. Kleiner, MD, PhD; Elmer Schabel, MD; Mary Rinella, MD; Stephen Harrison, MD; Vlad Ratziu, MD, PhD; Arun J. Sanyal, MD; Rohit Loomba, MD, MHSc; Sophie Jeannin Megnien, MD; Richard Torstenson, MScPharm, PhD; Veronica Miller, PhD.
Hepatology. 2019 Nov;70(5):1521-1530. doi: 10.1002/hep.30842. Epub 2019 Aug 19.
Ler artigo na íntegra.
Comentários: Dra. Ana Cláudia de Oliveira
Hoje comentaremos o artigo “Noninvasive tests accurately identify advanced fibrosis due to NASH: baseline data from STELLAR Trials” apresentado no AASLD em Novembro de 2018 e publicado no Hepatology em 2019. Trata-se de um estudo multicêntrico que incluiu pacientes de 26 países da América do Norte, Europa, Austrália, Nova Zelândia e Ásia, sob coordenação do Dr Quentin M Anstee, Newcastle UK.
Nesse estudo, os autores reuniram dados de screening de pacientes provenientes de 2 estudos fase 3, que analisavam o papel do selonsertib “apoptosis signal-regulating kinase 1 inhibitor”, em pacientes com NASH (STELLAR-3: fibrose em ponte ou F3 e STELLAR-4: cirrose compensada). Brevemente, os autores incluíram pacientes de 18 a 70 anos de idade, com histologia hepática compatível com NASH (NAS≥3 com pelo menos ≥1 para cada parâmetro histológico: esteatose, balonização e inflamação lobular), considerando a classificação NASH Clinical Research Network/CRN. Outras etiologias foram afastadas e para serem elegíveis os pacientes deveriam ter suas biópsias no máximo 6 meses do screening para o STELLAR-3 e 12 meses para o STELLAR-4. Foram realizadas dosagens bioquímicas de todos os pacientes na entrada dos estudos para cálculo dos 4 marcadores não invasivos (MNI) estudados: FIB4 (fibrosis-4), NFS (Nonalcoholic fatty liver disease fibrosis score), ELF (Enhanced Liver Fibrosis test) e elastografia hepática por meio da Elastografia Transitória (VCTE: vibration controlled transient elastography), que foram então comparados aos achados da histologia hepática.
O objetivo do estudo foi avaliar a performance dos quatro MNI em detectar fibrose avançada (≥F3) em portadores de doença hepática gordurosa não alcoólica (DHGNA), tendo a biópsia hepática como referência. A presença de fibrose avançada no contexto da DHGNA, sinaliza para uma doença progressiva e, principalmente, é um preditor independente de morbi-mortalidade geral e relacionada à doença hepática, sendo importante indicação de tratamento em ensaios clínicos.
Foram incluídos 4404 pacientes (n=2273 STELLAR-3 e n=2194 STELLAR-4), sendo que desses, 3202 tinham histologia disponível (n=896:28% biópsia histórica; n=2306:72% biópsia realizada para o estudo) e efetivamente participaram da análise.
Nessa casuística, a análise histológica revelou que 246 (8%) pacientes foram classificados como F0; 276 (9%)= F1, 418 (13%)= F2, 979 (31%)= F3 ou fibrose em ponte, 1283 (40%) eram F4 ou cirrose, ou seja: 940 (29%) eram F0F2 e 2262 (71%) eram F3F4 ou fibrose avançada (FA). Ao se analisar os MNI, os autores observaram que todos se correlacionaram com a fibrose (NFS=0,44; FIB4=0,51; ELF=0,53; ET=0,54, p<0,0001), e os valores médios do NFS, FIB4, ELF e ET aumentaram com o avançar da fibrose, sendo significativamente maior nos pacientes portadores de FA.
Ao se analisar a performance dos MNI na identificação da FA, os autores utilizaram diferentes estratégias de aplicação dos mesmos: 1- análise de um valor de corte único; 2- análise dicotômica de dois valores de corte (valor mais baixo com maior sensibilidade para afastar FA e um valor mais alto de maior especificidade para confirmar a FA), bem como empregaram os marcadores de forma simultânea e sequencial (Tabela 1). Para todas as avaliações foram utilizados os valores de corte definidos por uma curva ROC resultado do estudo e foram comparados com os valores de corte históricos da literatura. Como não houve diferença na análise comparativa, apenas os valores de corte da literatura foram enfatizados, trazendo os achados o mais próximo da prática clínica.
A tabela 1 resume os principais achados dos testes, em suas diferentes estratégias de aplicação, na identificação de FA (F3F4). Resumidamente, podemos observar que a aplicação de pontos de corte isolados apresentou performance “inaceitável” para esse fim, demonstrando um importante desbalanço entre sensibilidade (S) e especificidade (E) dos testes, apesar de uma AUROC moderada. A utilização da estratégia dicotomizada (2 pontos de cortes), tanto na avaliação dos MNI individualmente quanto na estratégia simultânea, foi capaz de melhorar os valores de S e E, como era de se esperar, porém foi marcada por uma grande porcentagem de indivíduos na “zona cinza”, ou seja, cujos valores dos MNI se encontraram entre os pontos de corte dicotomizados e não puderam ser classificados. Esse fato faz dessa estratégia igualmente “inaceitável”, segundo avaliação dos próprios autores, visto que até 70% dos indivíduos se enquadraram nessa “zona cinza” e, portanto, não puderam ser classificados. Por outro lado, o emprego dos marcadores na estratégia sequencial (ou seja, utilizou-se o segundo MNI apenas na “zona cinza” do primeiro), foi capaz de reduzir o número de pacientes não classificados para cerca de 20%. Utilizando-se dessa estratégia sequencial, a porcentagem de erro de diagnóstico alcançou a ordem de 20%, mantendo aceitável S e E, identificando-se 20% de falsos-positivos (MNI positivo para a presença de FA e bx negativa) e 11% de falso-negativo (MNI negativo para FA e bx positiva). No entendimento dos autores, o acréscimo de 20% de pacientes que seriam encaminhados para tratamento sem necessidade (falso-positivo), não representa “excesso de tratamento”, sendo considerado um “erro” permissivo que beneficiaria os pacientes no seu acompanhamento. Porém, um fato curioso levantado pelos autores é que, ao se analisar individualmente as características clínicas e laboratoriais desses indivíduos (idade, bilirrubinas, MELD, plaquetas, AST, ALT, etc.), os mesmo se comportavam mais favoravelmente à presença de doença avançada do que à ausência da mesma, ao contrário do que demonstrou a biópsia hepática (o mesmo pôde ser observado em relação aos 11% de falsos-negativos). Essa discrepância entre os achados dos MNI e a biópsia hepática poderia ser explicada, pelas limitações da própria biópsia, como observado em estudos prévios, que defendem que a biópsia hepática não seja um método perfeito sendo passível de erros de classificação, particularmente na DHGNA que tem como característica ser uma doença de distribuição heterogênea através do parênquima hepático (1-4).
Outro fato curioso, que foi detectado no estudo e vem sendo levantado na literatura, é a diferente performance dos MNI de acordo com a idade dos indivíduos. Como era de se esperar, a prevalência de FA aumentou com o aumento da idade dos indivíduos, o que foi acompanhado por um aumento na S e redução na E dos MNI de uma forma geral. Nesse contexto, o presente estudo observou uma redução na performance do NFS na idade acima de 65 anos e do FIB4 na faixa etária mais jovem, sugerindo que seja necessário um ajuste dos MNI de acordo com a idade analisada. Ainda que valha como uma reflexão, nenhuma recomendação formal se faz nesse sentido, até o presente momento.
O estudo conclui que os MNI comumente disponíveis na literatura tiveram boa performance na identificação de FA em indivíduos portadores de DHNGA. Porém, ressaltam que uma certa falta de acurácia, particularmente quando se utiliza uma referência não perfeita como é o caso da biópsia hepática, será melhor avaliada à luz da eficácia e segurança dos tratamentos disponíveis.
As maiores potencialidades do estudo se relacionam ao grande número de indivíduos incluídos, e sua característica internacional envolvendo pacientes provenientes de 26 países ao redor do mundo.
As principais limitações desse estudo se relacionam a não padronização da realização da biópsia no screening (31% dos indivíduos utilizaram biópsia histórica) e a altíssima prevalência de FA (variou de 71 a 84% da amostra), o que dificulta a análise dos valores preditivos negativo e positivo, portanto dificultando a extrapolação dos dados encontrados para a prática clínica, onde a prevalência de FA encontra-se bem abaixo das cifras apresentadas no estudo. Porém, ainda assim reforça a empregabilidade desses marcadores, principalmente dos marcadores bioquímicos, como primeira linha na avaliação de pacientes em investigação de DHGNA, devendo aqueles que se encontrarem na “zona cinza” serem referenciados para um serviço especializado no tratamento desses indivíduos para adequado seguimento (5).
Tabela 1: Performance dos MNI (NFS, FIB4, ELF e ET) na identificação de fibrose avançada (F3F4):
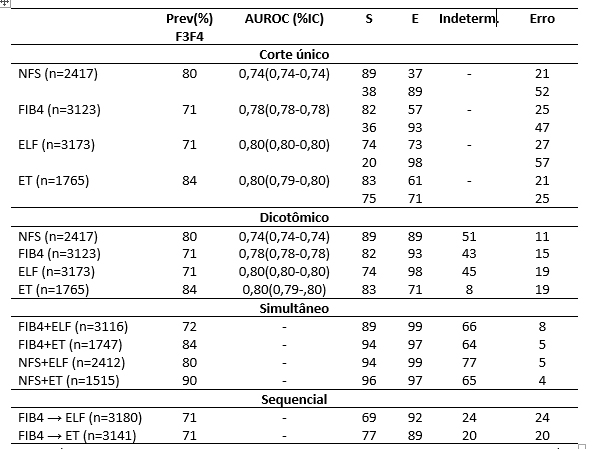
Pontos de corte: NFS= <-1,455 - ≥0,676; FIB4= <1,3 - ≥2,67; ELF=<9,8 - ≥11,3; ET=<9,9 -≥11,4kPa
Abreviações: MNI: marcadores não-invasivos; Prev: prevalência; NFS: NAFLD fibrosis score; FIB4: fibrosis 4; ELF: Enhanced Liver Fibrosis test; ET: elastografia transitória; AUROC: área sob a curva; %IC: intervalo de confiança; S: sensibilidade; E: especificidade.
- Tapper EB, Lok ASF. Use of liver imaging and biopsy in clinical practice. N Eng J Med 2017;377:756-768
- Chalasani N, Younossi Z, Lavine JE, Charlton M, Cusi K et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Disease. Hepatology 2017;67:328-357
- Rockey DC, Cladwell SH, Goodman ZD, Nelson RC, Smith AD. American Association for the Study of Liver Disease: Liver biopsy. Hepatology 2009;49:1017-1044.
- Ratziu V, Charlotte F, Heurrier A, Gombert S, Giral P et al. LIDO Study Group. Sampling variability of liver biopsy in nonalcoholic fatty liver disease. Gastroenterology 2005;128:1898-1906.
- Castera L, Friedrich-Rust M and Loomba R. Noninvasive Assessment of Liver Disease in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2019;1–19
